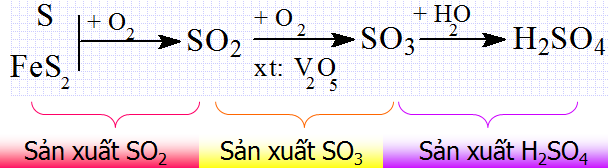Lý thuyết Axit sunfuric Muối sunfat chi tiết nhất
Axit sunfuric muối sunfat là một bài trong chương trình Hóa học 10 cấp Trung học phổ thông. Cunghocvui xin gửi đến các bạn bài tóm tắt lý thuyết và các dạng bài tập về axit sunfuric và muối sunfat đầy đủ và chi tiết nhất. Hy vọng tài liệu tham khảo này sẽ giúp ích các bạn.
A. Tóm tắt lý thuyết bài giảng axit sunfuric muối sunfat
1. Axit sunfuric
a, Tính chất vật lý của axit sunfuric
- Axit sunfuric có dạng chất lỏng trong suốt không màu, sánh và có đặc điểm không bay hơi.
- Ở trong môi trường nước, axit sunfuric tan vô hạn và khi axit sunfuric tan, một lượng nhiệt lớn được tỏa ra.
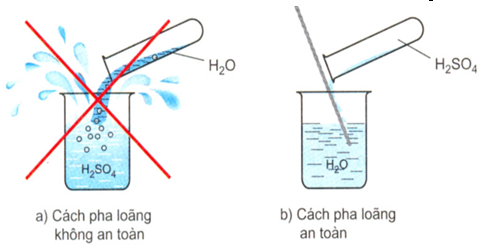
- Phương pháp làm loãng axit sunfuric đặc là từ từ rót axit sunfuric đặc vào trong nước theo chiều dọc của chiếc đũa thủy tinh đồng thời khuấy đều (chỉ áp dụng một cách duy nhất, không được làm ngược lại). Bởi vì, khi axit sunfuric tan vào nước, một lượng nhiệt rất lớn sẽ được tỏa ra. Đổ ào ạt có thể sẽ làm nước sôi đột ngột và nước bắn ra ngoài, gây nên bỏng nước hoặc bỏng axit.
b, Tính chất hóa học của axit sunfuric
b.1, Với axit sunfuric loãng
- Vì là một axit nên axit sunfuric cũng làm chuyển màu quỳ tím sang đỏ
- Phản ứng với các kim loại đứng trước H (ngoại trừ Pb) để tạo thành muối sunfat và khí hidro
Ví dụ: \(Fe + H_{2}SO_{4}\rightarrow FeSO_{4}+H_{2}\)
- Axit sunfuric tác dụng với bazo và oxit bazo để kết quả thu về được muối và nước
Ví dụ: \(Na_{2}O + H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O\)
\(2NaOH + H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2H_{2}O\)
- Axit sunfuric phản ứng với muối của axit yếu hơn tạo thành một muối mới và axit mới
Ví dụ: \(Na_{2}Co_{3} + H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+CO_{2}+2H_{2}O\)
b.2, Với axit sunfuric đặc
- Axit sunfuric đặc nóng có tính oxi hóa mạnh, phản ứng được với hầu hết các kim loại ngoại trừ Au, Pt
\(M + H_{2}SO_{4}\rightarrow M_{2}(SO_{4})_{n}+(SO_{2}, H_{2}S, S)+H_{2}O\) với n = hóa trị max của kim loại
Ví dụ: \(Cu + 2H_{2}SO_{4}\rightarrow CuSO_{4}+SO_{2}+2H_{2}O\)
- Với một số kim loại là Al, Fe và Cr axit sunfuric đặc nguội sẽ không phản ứng
- Với phi kim có tính khử, axit sunfuric phản ứng để thu về được một hợp chất của phi kim với số oxi hóa cao nhất ngoại trừ S
\(2H_{2}SO_{4} + C\rightarrow CO_{2}+ 2SO_{2}+2H_{2}O\)
- Với hợp chất có tính khử, axit sunfuric phản ứng:
\(3H_{2}SO_{4} + KBr\rightarrow 4SO_{2}+4H_{2}O\)
- Axit sunfuric đặc có tính háo nước, hóa than các hợp chất ví dụ như glucozo, xenlulozo và tinh bột bằng cách lấy nước từ các hợp chất hữu cơ
Ví dụ: Trong một cốc đựng đường, cho một lượng axit sunfuric đặc. Kết quả cho ra hiện tượng đường sôi trào và biến thành màu đen.
\(H_{2}SO_{4} + C_{12}H_{22}O_{11}\rightarrow 12C + H_{2}SO_{4}+ 11H_{2}O\)
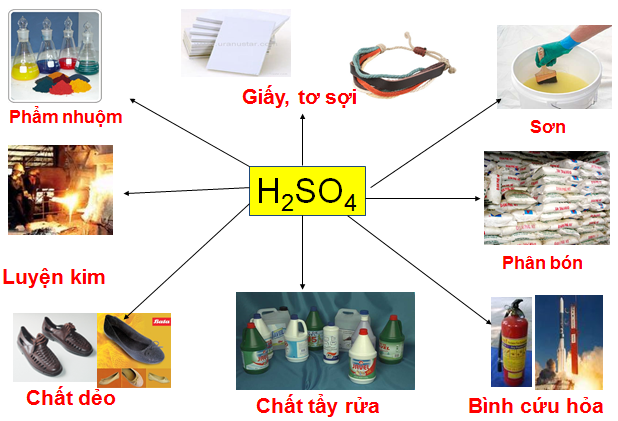
c. Ứng dụng của axit sunfuric
- Trong cuộc sống, axit sunfuric là nguyên liệu để sản xuất một số sản phẩm.
d, Sản xuất axit sunfuric
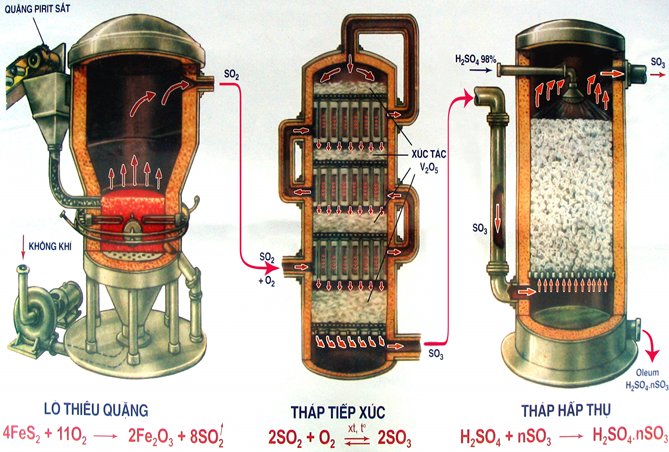
- Trong công nghiệp, axit sunfuric được sản xuất bằng cách tiếp xúc. Cách này bao gồm ba bước chính:
+ Bước 1: Sản xuất \(SO_{2}\) bằng cách đốt cháy các nguyên liệu có sẵn từ tự nhiên. Nguyên liệu bao gồm lưu huỳnh (S) hoặc pirit sắt (\(FeS_{2}\)).
+ Bước 2: Sản xuất \(SO_{3}\) bằng cách oxi hóa \(SO_{2}\) bằng oxi hoặc không khí dư trong điều kiện \(400^oC - 500^oC\) với chất xúc tác có \(V_{2}O_{5}\)
+ Bước 3: Dùng axit sunfuric để hấp thụ \(SO_{3}\) bằng cách ngược dòng. Ở tháp hấp thụ, cho \(SO_{3}\) và \(H_{2}SO_{4}\) đi ngược chiều nhau, nếu \(SO_{3}\) đi theo một hướng từ dưới lên thì \(H_{2}SO_{4}\) đi theo một hướng từ trên xuống với diện tích tiếp xúc là tối đa, hiệu suất hấp thụ đạt được ở mức cao nhất.
2. Muối sunfat. Nhận biết axit sunfuric và muối sunfat
- Muối sunfat bao gồm:
+ Muối trung hòa có gốc như \((SO_{4})^{2-}\). Các muối trung hòa đa số đều tan trong nước ngoại trừ \(BaSO_{4}\), \(SrSO_{4}\), \(PbSO_{4}\) không tan trong nước và \(CaSO_{4}\), \(Ag_{2}SO_{4}\) ít tan.
+ Muối axit có gốc là \((HSO_{4})^{-}\). Các muối axit đều có tính tan trong nước.
- Cách nhận biết axit sunfuric và muối sunfat
+ Để nhận biết \(H_{2}SO_{4}\), ta có thể dùng giấy quỳ tím \(H_{2}SO_{4}\) làm quỳ tím chuyển đỏ
+ Để nhận biết các muối sunfat, ta có thể dùng dung dịch muối của kim loại Ba, \(Ba(OH)_{2} \) để kết quả thu được một kết tủa trắng, không tan.
\(Ba(OH)_{2} +Na_{2}SO_{4}\rightarrow BaSO_{4} + 2NaOH\)
B. Bài tập về axit sunfuric và muối sunfat
1. Một số bài tập tự luận axit sunfuric muối sunfat
Bài 1: Cho một lượng hỗn hợp 11,1g bao gồm ba kim loại được chứa trong dung dịch \(H_{2}SO_{4}\) ở dạng loãng. Kết quả ta thu về được một lượng dung dịch X và 8,96 lít khí ở điều kiện tiêu chuẩn. Thu về được m gam muối khan bằng cách cô cạn dung dịch X. Hỏi khối lượng m thu về được là bao nhiêu?
Đáp số: 49,5g
Bài 2: Hoà tan vừa đủ một lượng hỗn hợp 2,81g chứa ba oxit là \(Fe_{2}O_{3}\), MgO, ZnO bằng một lượng 300ml dung dịch \(H_{2}SO_{4}\) 0,1M. Kết quả nhận được m gam muối sunfat khan. Tính m muối thu được?
Đáp số: 5,21g
Bài 3: Một lượng 13,428g kim loại M phản ứng với dung dịch \(H_{2}SO_{4}\) đặc nóng. Kết quả thu về được V lít khí \(H_{2}S\) ở điều kiện tiêu chuẩn và một dung dịch A. Cô cạn A thu về được 66,24g muối khan. Hỏi thể tích V bằng bao nhiêu?
Đáp số: 3,0807 lít
Bài 4: Dùng một lượng 45g một hỗn hợp gồm hai kim loại là Zn và Cu phản ứng vừa đủ với dung dịch \(H_{2}SO_{4}\) đặc nóng 98%. Kết quả tạo thành có 15,68 lít khí \(\)\(SO_{2}\) ở điều kiện tiêu chuẩn. Khối lượng của \(H_{2}SO_{4}\) được dùng là bao nhiêu?
Đáp số: 140g
Bài 5: Dùng một lượng 2,52g hỗn hợp bao gồm 2 kim loại Al và Mg theo tỉ lệ 2:3 phản ứng với dung dịch \(H_{2}SO_{4}\) đặc. Kết quả tạo thành có một muối sunfat và 0,03 mol một chất khử chứa lưu huỳnh. Vậy sản phẩm khử là?
Đáp số: Sản phẩm khử là \(H_{2}S\)
2. Một số bài tập trắc nghiệm về axit sunfuric muối sunfat
Câu 1: Cho các kim loại: Al, Mg, Na, Cu. Kim loại không tác dụng với \(H_{2}SO_{4}\) là:
A. Al B. Mg
C. Na D. Cu
Câu 2: Cho một phương trình phản ứng hóa học sau:
\(aAl +bH_{2}SO_{4}\rightarrow cAl_{2}(SO_{4})_{3}+dSO_{2}+eH_{2}O\)
Tỉ lệ của a:b là:
A. 1:1 B. 2:3
C. 1:3 D. 1:2
Câu 3: Cho một dãy các chất sau:
\(KBr, S,SiO_{2}, P, Na_{3}PO_{4},FeO, Cu, Fe_{2}O_{3}\)
Trong tám chất, dung dịch \(H_{2}SO_{4}\) oxi hóa được số chất là:
A. 4 B. 5
C. 6 D. 7
Câu 4: Dùng axit \(H_{2}SO_{4}\) đặc, nóng dư để hòa tan một lượng 12,8g kim loại Cu. Kết quả tạo thành có V lít khí \(SO_{2}\) ở điều kiện tiêu chuẩn. V bằng:
A. 4.48 lít B. 2,24 lít
C. 6,72 lít D. 8,96 lít
Câu 5: Dùng dung dịch \(H_{2}SO_{4}\) đặc, nóng dư để phản ứng hết với một hỗn hợp hai chất bao gồm 1 mol chất X và 1 mol chất Y. Kết quả thu được tạo ra 1 mol khí \(SO_{2}\). Tên của 2 chất X, Y là:
A. Fe, \(Fe_{2}O_{3}\) B. Fe, FeO
C. \(Fe_{3}O_{4}, Fe_{2}O_{3}\) D. \(Fe_{3}O_{4}, FeO\)
Câu 6: Dùng một lượng dung dịch \(H_{2}SO_{4}\) 10% để phản ứng hết với một lượng 3,68g một hỗn hợp bao gồm 2 kim loại là Al và Zn. Kết quả tạo thành có 2,24 lít khí \(H_{2}\) ở điều kiện tiêu chuẩn. Dung dịch được tạo sau phản ứng có khối lượng là:
A. 97,8g B. 101,48g C. 88,2g D. 101,68g
Câu 7: Dùng một lượng m gam một kim loại M (hóa trị II) phản ứng với dung dịch \(H_{2}SO_{4}\) đặc, nóng. Kết quả tạo thành thu được 0,672 lít một khí có tỷ khối so với amoniac là 2 và một dung dịch. Cô cạn A tạo thành 14,4g muối khan. Tên M là:
A. Ca B. Mg
C. Zn D. Ba
Câu 8: Dùng dung dịch \(H_{2}SO_{4}\) để hòa tan hoàn toàn 21g một hỗn hợp bao gồm Fe, Zn và Al. Kết quả thu về tạo thành 6,72 lít khí \(H_{2}\) (được đo ở \(0^0C\) và 2atm). Sau khi cô cạn dung dịch, khối lượng muối khan thu được và thể tích dung dịch axit tối thiểu cần để dùng là:
A. 78,6g và 1,2 lít
B. 46,4g và 2,24 lít
c. 46,4g và 1,2 lít
D. 78,6g và 2,24 lít
Câu 9: Một lượng hỗn hợp X có 3 kim loại bao gồm 5,4g Ag, 2,7g Al và 16,8g Fe được hòa tan và phản ứng với \(H_{2}SO_{4}\) đặc, nóng. Kết quả thu được về chỉ cho ra một sản phẩm duy nhất là khí \(SO_{2}\). \(H_{2}SO_{4}\)dùng để tác dụng có số mol là:
A. 0,95 mol B. 0,9 mol
C. 1,25 mol D. 0,85 mol
Câu 10: Dùng \(H_{2}SO_{4}\) đặc, nóng để phản ứng với một lượng m gam một hỗn hợp hai kim loại. Kết quả tạo thành 3,36 lít khí \(SO_{2}\) ở điều kiện tiêu chuẩn, 2,88g lưu huỳnh và một dung dịch X. Cô cạn X thu về được 52,8g muối khan. Mặt khác, nếu dùng dung dịch HCl để hòa tan hoàn toàn hỗn hợp ban đầu thì kết quả tạo thành thu được 8,064 lít khí H ở điều kiện tiêu chuẩn. Vậy hai kim loại có trong hỗn hợp là:
A. Be và Mg B. Mg và Fe
C. Zn và Fe D. Zn và Ba
| Câu | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| Đáp án | D | C | B | A | D | B | B | A | C | B |
Xem thêm >>> Giải bài tập Hóa học 10 bài 23 Axit sunfuric Muối sunfat
Với Bài 33 Hóa học 10 Axit sunfuric muối sunfat, Cunghocvui đã đem đến cho các bạn bài tóm tắt lý thuyết và các dạng bài tập đầy đủ nhất. Nếu có đóng góp gì cho bài viết Axit sunfuric muối sunfat, hãy để lại comment ở dưới phần bình luận nhé!